Resulta vital elegir una etiqueta fabricada con materiales de calidad farmacéutica para garantizar la seguridad de los productos farmacéuticos. En UPM Raflatac garantizamos la seguridad de nuestras etiquetas utilizando materiales rigurosamente probados que cumplen los requisitos normativos aplicables para su uso previsto y ofrecen un suministro garantizado a largo plazo.
Etiquetas farmacéuticas diseñadas para garantizar la conformidad con las normativas
Etiquetas farmacéuticas desarrolladas, formuladas y fabricadas para garantizar la total conformidad con las normativas
Protección de las personas
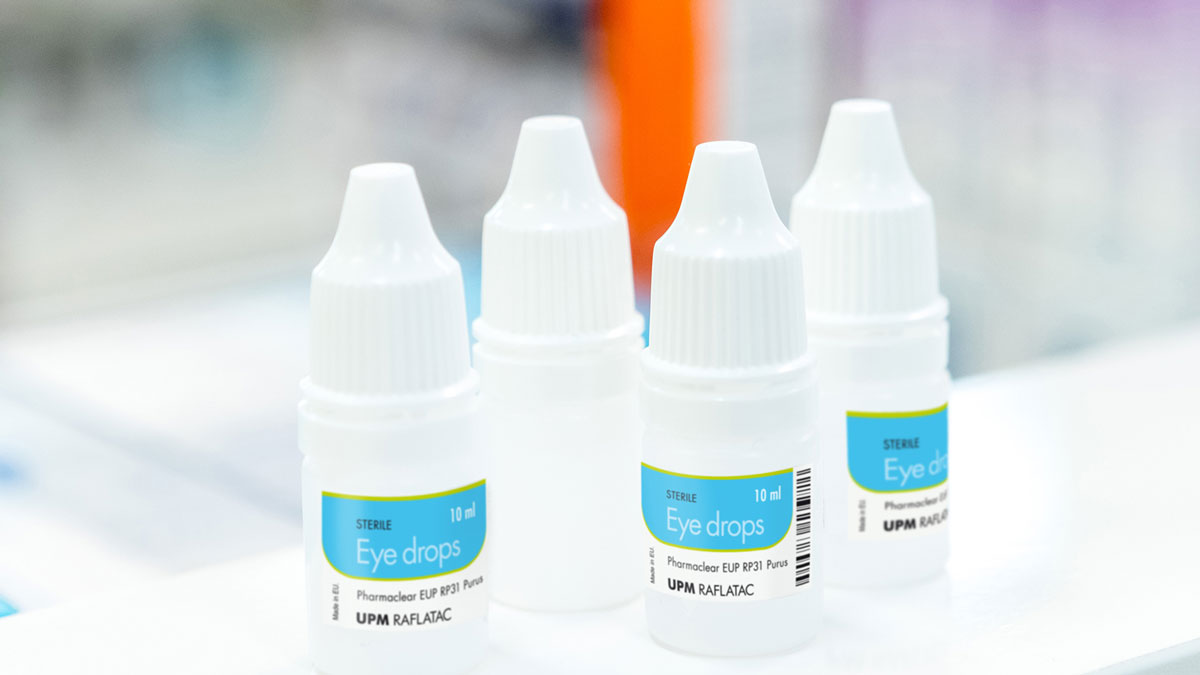
Etiquetas farmacéuticas de baja migración
Las etiquetas desempeñan un papel importante en la protección de la seguridad al contener información médica fundamental. Las etiquetas también pueden ser motivo de preocupación en los casos en los que ciertos productos farmacéuticos requieran materiales de baja migración. Algunos ejemplos de productos farmacéuticos que pueden requerir etiquetas con un bajo nivel de lixiviado son los medicamentos líquidos envasados en recipientes de plástico, como colirios, aerosoles nasales o inyectables. Nuestros materiales farmacéuticos seleccionados y nuestra avanzada tecnología adhesiva se han desarrollado de acuerdo con las directrices del sector, como:
- Directriz de la EMA (Agencia Europea de Medicamentos)/el CVMP/205/04 sobre materiales de envases inmediatos de plástico (2005).
- Guía de la FDA (Agencia de Medicamentos y Alimentos de EE. UU.) sobre sistemas de cierre de envases para el envasado de productos biológicos y fármacos de uso humano (1999).
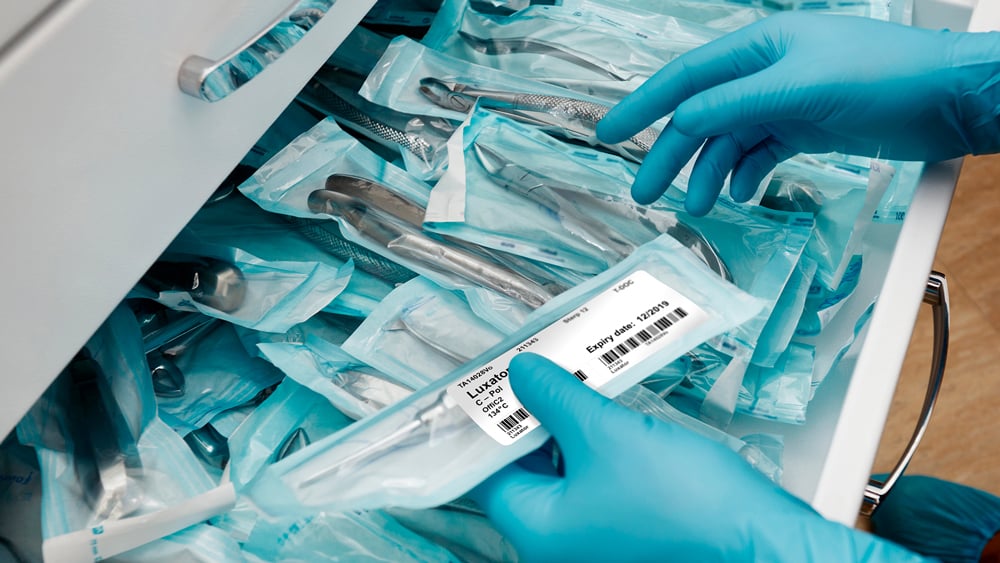
Normativas sobre dispositivos médicos
Las directrices sobre dispositivos médicos requieren que los sistemas de impresión y etiquetado sean compatibles con el procesamiento del sistema, los dispositivos y los materiales de la barrera estéril, así como que permanezcan intactos y legibles hasta el momento de su uso. El etiquetado de dispositivos médicos ayuda a los pacientes o usuarios finales a comprender el funcionamiento, los cuidados y el mantenimiento que requiere el dispositivo. Entre las normativas sobre dispositivos médicos se encuentran:
- La normativa mundial de reciente aparición sobre dispositivos médicos que incluye la adopción de un sistema de serialización para la Identificación Única de Dispositivos (UDI, por sus siglas en inglés) que marque e identifique los dispositivos médicos existentes en la cadena de suministro sanitario. Una de las últimas novedades de la UDI es el nuevo Reglamento sobre los Productos Sanitarios de la UE (MDR, por sus siglas en inglés) cuya fecha límite de implementación es mayo de 2020, y que implanta un sistema similar al adoptado por la FDA de EE. UU. en 2013.
- El Reglamento sobre Diagnóstico In Vitro (IVDR, por sus siglas en inglés) es la base legislativa para la comercialización, entrega y puesta en servicio de los dispositivos médicos de diagnóstico in vitro en el mercado europeo. La fecha límite para la implementación del Reglamento sobre Diagnóstico In Vitro (IVDR) en la UE es mayo de 2022.
Directiva sobre Medicamentos Falsificados (2011/62/UE)
La Directiva sobre Medicamentos Falsificados (2011/62/UE) hace referencia al envasado de medicamentos con receta y medicinas de alto riesgo sin receta. El cumplimiento normativo se logra incorporando propiedades a prueba de manipulaciones como las descritas en la norma ISO 21976 "Envasado: características de verificación de manipulaciones para envases de medicamentos", que respaldan la armonización e implementación de características de verificación de manipulación para envases de productos médicos de todo el mundo.
Normativas en materia de envasado
Nuestros materiales de etiquetado para productos farmacéuticos y sanitarios están diseñados para cumplir las normativas en materia de envasado. Nuestros materiales de etiquetado cumplen todos los requisitos normativos y de seguridad pertinentes para el envasado y el contacto con alimentos para su uso previsto:
- Normativas de envasado relativas a los metales pesados en relación con la Directiva 94/62/CE de la UE y el Centro de Información sobre Sustancias Tóxicas en Envases (TPCH, por sus siglas en inglés), anteriormente conocido como la Coalición de Gobernadores del Noreste de EE. UU. (CONEG, por sus siglas en inglés).
- Los adhesivos se han evaluado para garantizar el cumplimiento de las normativas europeas sobre el contacto con alimentos:
- Reglamento Marco sobre Alimentos (CE) n.º 1935/2004 relativo a los materiales y objetos destinados a entrar en contacto con alimentos.
- Reglamento (CE) n.º 2023/2006 sobre las buenas prácticas de fabricación de materiales y objetos destinados a entrar en contacto con alimentos.
- Cumplimiento de la FDA en materia de contacto con alimentos:
- FDA 21 CFR, sección 110: Buenas prácticas de fabricación (GMP).
¿Por qué utilizar soluciones de etiquetado específicas para el sector farmacéutico?
Las etiquetas contienen información médica fundamental a lo largo del ciclo de vida del producto, a la vez que desempeñan un papel en la protección y el sellado del contenido del producto. Por tanto, algunas de las cualidades que debe tener la etiqueta son: gran durabilidad, calidad de impresión, rendimiento, cumplimiento normativo y seguridad del producto. Al escoger soluciones de etiquetado específicas para el sector farmacéutico, las marcas y las empresas se aseguran de que esos materiales de etiquetado:
- Estén diseñados y probados previamente para aplicaciones farmacéuticas.
- Se desarrollen teniendo en cuenta la seguridad del producto y el cumplimiento de las normativas.
- Proporcionen una disponibilidad y estabilidad a largo plazo, con notificaciones de gestión de cambios y disponibilidad garantizada.
- Estén respaldados por un servicio de documentación que ayude en la validación normativa de los productos por parte de los usuarios finales.