Die Auswahl eines Etikettenmaterials in Pharmaqualität ist entscheidend für die Sicherheit pharmazeutischer Produkte. Bei UPM Raflatac gewährleisten wir die Sicherheit unserer Etiketten durch die Verwendung von Materialien, die strengen Vorabprüfungen unterzogen wurden, geltende Gesetzesvorschriften für den vorgesehenen Verwendungszweck erfüllen und langfristig verfügbar sind.
Vorschriftskonforme Etiketten für Arzneimittelverpackungen
Pharmazeutische Etiketten, die im Hinblick auf die Einhaltung gesetzlicher Vorschriften entwickelt, formuliert und hergestellt wurden
Menschen schützen
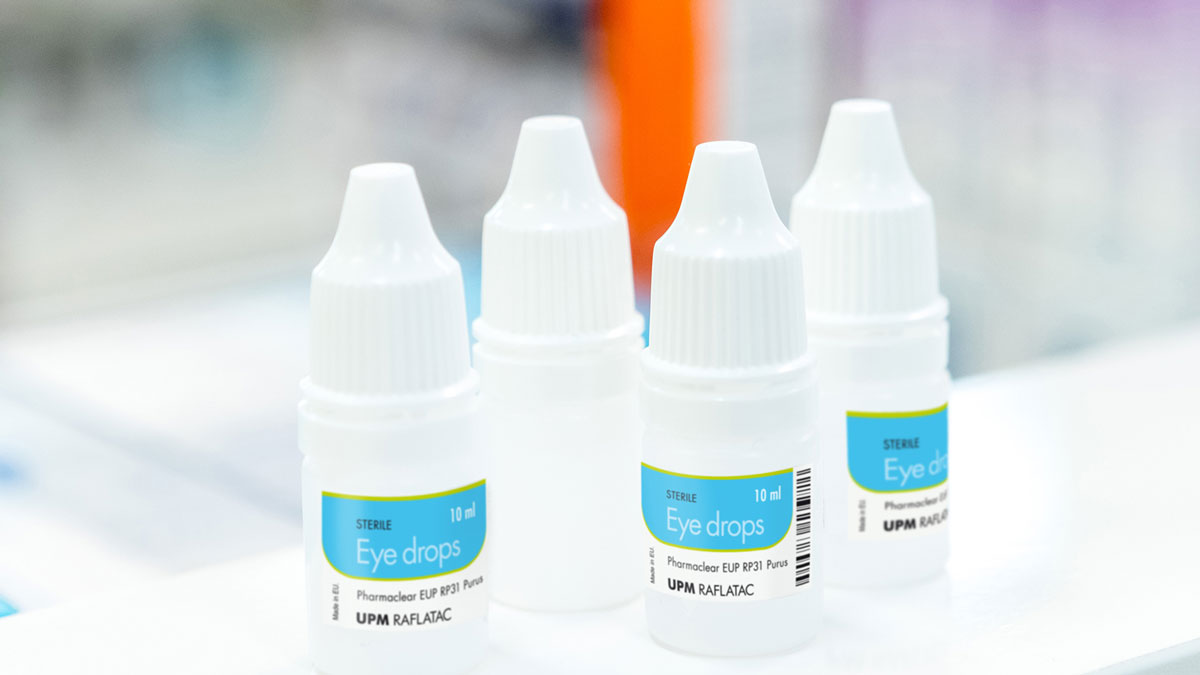
Migrationsarme Pharmaetiketten
Etiketten spielen eine wichtige Rolle für die Sicherheit, da sie wichtige medizinische Informationen enthalten. Probleme mit Etiketten können auftreten, wenn für bestimmte Pharmaprodukte migrationsarme Materialien erforderlich sind. Beispiele für Pharmaprodukte, deren Etiketten nur eine geringe Auslaugbarkeit aufweisen dürfen, sind flüssige Medikamente in Kunststoffverpackungen wie Augentropfen, Nasensprays oder Injektionslösungen. Unsere ausgewählten pharmazeutischen Materialien und unsere fortschrittliche Klebstofftechnologie entsprechen den folgenden Branchenrichtlinien:
- EMA (European Medicines Agency; Europäische Arzneimittel-Agentur) /CVMP/205/04: „Guideline on Plastic Immediate Packaging Materials“ (2005)
- FDA (Food and Drug Administration, USA; US-amerikanische Behörde für Lebensmittel- und Arzneimittelsicherheit): „Guidance on Container Closure Systems for Packaging Human Drugs and Biologics“ (1999)
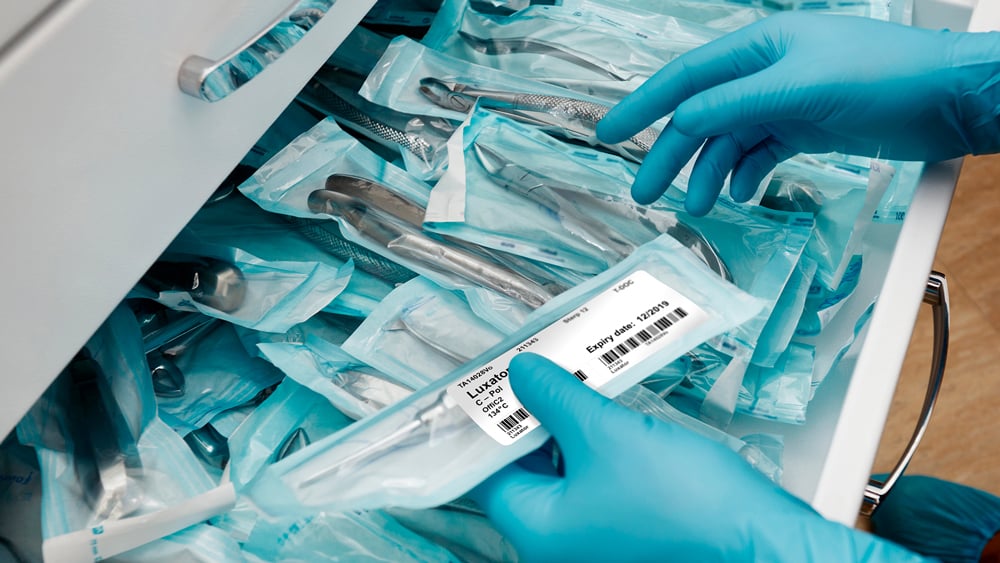
Vorschriften für Medizinprodukte
Die Richtlinien für Medizinprodukte verlangen, dass die Druck- und Etikettiersysteme mit den Verarbeitungsbedingungen, dem Gerät und den Materialien des Sterilbarrieresystems kompatibel sind und dass die Informationen bis zum Zeitpunkt der Verwendung intakt und lesbar bleiben müssen. Die Etikettierung von Medizinprodukten hilft Patienten und Endanwendern beim Verständnis der Funktionsweise des Produkts, seiner Bedienung, Pflege und Wartung. Zu den Vorschriften für Medizinprodukte gehören:
- Die neue weltweite Verordnung für Medizinprodukte beinhaltet die Einführung eines eindeutigen Produkterkennungssystems (Unique Device Identification, UDI) in der Lieferkette von Medizinprodukten. Eine der neuesten diesbezüglichen Vorschriften ist die neue EU-Verordnung für Medizinprodukte (Medical Device Regulation, MDR), die bis Mai 2020 umgesetzt werden muss und ähnliche Maßnahmen wie das 2013 von der US-amerikanischen FDA eingeführte System vorsieht.
- The In Vitro Diagnostics Regulations (IVDR) is the regulatory basis for placing on the market, making available and putting into service in vitro diagnostic medical devices on the European market. The deadline for implementing the In Vitro Diagnostics Regulations (IVDR) in EU is May 2022.
Fälschungsschutzrichtlinie (2011/62/EU)
Die Fälschungsschutzrichtlinie (2011/62/EU) bezieht sich auf Verpackungen von verschreibungspflichtigen und risikoreichen rezeptfreien Arzneimitteln. Die Compliance wird durch die Integration manipulationssicherer Funktionen erreicht, die in der Norm ISO 21976 „Verpackung – Merkmale zur Überprüfung von Manipulationen an Arzneimittelverpackungen“ beschrieben werden und die Harmonisierung und Implementierung manipulationssicherer Funktionen für die Verpackungen von Medizinprodukten Produkte auf der ganzen Welt unterstützen.
Verpackungsvorschriften
Unsere Etikettenmaterialien für Pharma- und Gesundheitsprodukte sind auf die Einhaltung der Verpackungsvorschriften ausgelegt. Unsere Etikettenmaterialien erfüllen alle geltenden Gesetze und Sicherheitsvorschriften für Verpackungen und Lebensmittelkontakt für den vorgesehenen Verwendungszweck:
- Verpackungsvorschriften für Schwermetalle im Hinblick auf die EU-Richtlinie 94/62/EG und die US-amerikanische Richtlinie Toxics in Packaging Clearinghouse (TPCH), früher bekannt als Coalition of North-Eastern Governors (CONEG).
- Alle Klebstoffe wurden im Hinblick auf die europäischen Vorschriften für den Kontakt mit Lebensmitteln geprüft:
- Verordnung (EG) Nr. 1935/2004 über Materialien und Gegenstände, die dazu bestimmt sind, mit Lebensmitteln in Berührung zu kommen, und
- Verordnung (EG) Nr. 2023/2006 über gute Herstellungspraxis für Materialien und Gegenstände, die dazu bestimmt sind, mit Lebensmitteln in Berührung zu kommen.
- Einhaltung der FDA-Vorschriften für den Kontakt mit Lebensmitteln:
- FDA 21 CFR § 110 – Good Manufacturing Practices (GMP)
Warum der Einsatz spezieller Pharmaetikettenlösungen sinnvoll ist
Etiketten enthalten über den gesamten Nutzungskreislauf des Produkts hinweg wichtige medizinische Informationen und schützen und versiegeln den Packungsinhalt. Lange Haltbarkeit, Druckqualität, Leistung, Gesetzeskonformität und Produktsicherheit sind nur einige der Merkmale, die das Etikett aufweisen muss. Durch die Auswahl spezieller Lösungen für Pharmaetiketten können Marken und Unternehmen sicher sein, dass ihre Etikettenmaterialien:
- für pharmazeutische Anwendungen konzipiert und getestet wurden
- unter Berücksichtigung der Produktsicherheit und Compliance entwickelt wurden
- die stabile, langfristig abgesicherte Verfügbarkeit mit Benachrichtigungen im Rahmen des Änderungsmanagements und Verfügbarkeitsgarantien gewährleisten.
- mit einem Dokumentationsservice unterstützt werden, der dabei hilft, die aufsichtsrechtlich vorgeschriebene Validierung von Endanwenderprodukten zu bestehen